Foire aux questions Vaccination COVID-19
La campagne de vaccination des personnels de l’AP-HM contre la COVID a démarré mardi dernier dans les Hôpitaux Universitaires de Marseille.
De nombreuses informations, parfois fausses, circulent sur la vaccination pouvant ainsi entraîner doutes et réticences.
Cette Foire Aux Questions a pour but de répondre aux questions que vous vous posez sur la vaccination en général et sur l’organisation mise en place à l’AP-HM. Elle sera régulièrement mise à jour. N’hésitez pas à poser vos questions aux médecins et aux cadres qui vous entourent ou par mail à infocovid19@ap-hm.fr
Organisation de la vaccination
à l’AP-HM
1 - QUI PEUT SE FAIRE VACCINER ?
La campagne de vaccination des personnels a démarré mardi 5 janvier dans l’ensemble des établissements des Hôpitaux Universitaires de Marseille.
Elle concerne l’ensemble des personnels hospitaliers volontaires de + de 50 ans ou de – de 50 ans présentant des comorbidités.. Mais très vite la vaccination va être élargie à tous les professionnels.
2 - COMMENT ME FAIRE VACCINER ?
Vous pouvez soit téléphoner, soit vous rendre directement dans un des services de médecine et de santé au travail soit via Doctolib en quelques clics : https://www.doctolib.fr/hopital-public/marseille/vaccinationcovidaphm
Nous vous conseillons de privilégier cette prise de rendez-vous en ligne. De nombreux rendez-vous sont proposés !
Dans tous les cas, pour gagner du temps, le jour de votre vaccination, pensez à vous munir de votre badge professionnel et de votre numéro de sécurité sociale !
3 - OÙ ME FAIRE VACCINER ?
À l’Hôpital de la Timone :
entre 8h00 et 16h00 du lundi au vendredi, et entre 7h00 et 8h00 le vendredi exclusivement pour les personnels de Nuit, dans les locaux du service de médecine et de santé au travail - Tél. : 85 087 – 85 088 – 85 089 (Bastide 1er étage)
ou entre 8h30 et 16h30 dans les locaux du service de médecine et de santé au travail (Bât 10) - Tél : 85 091
À l'Hôpital de la Conception :
dans les locaux du service de médecine et de santé au travail entre 8h30 et 16h30 du lundi au vendredi – Tél : 83 889 - Le service a déménagé le lundi 11 janvier. Il est situé désormais au 2ème est - Bat Central.
À l’Hôpital Nord : Prendre RDV au 64465
salle n°2 de l’espace hospitalo-universitaire (rdc du pavillon étoile) du lundi au vendredi de 8h30 à 17h30 et les mardi et jeudi de 6h30 à 8h30 pour les personnels de nuit - Tél : 64.465
Aux Hôpitaux Sud :
dans les locaux du service de médecine et de santé au travail du lundi au vendredi entre 8h30 et 16h30 - Tél : 44 025
4 - UNE FOIS VACCINÉ(E), JE SUIS COMPLÈTEMENT PROTÉGÉ(E) DE LA COVID 19 ?
Il est rappelé que la vaccination protège les personnes vaccinées mais ne garantit pas à ce stade des connaissances scientifiques, la non contagiosité. Il est essentiel pour les personnes vaccinées de continuer à respecter scrupuleusement les gestes barrières (port du masque, lavage des mains, distanciation ...) afin de continuer à lutter contre la transmission du virus.
5 - VA-T-ON VACCINER D’AUTRES POPULATIONS DANS LES ÉTABLISSEMENTS DES HÔPITAUX UNIVERSITAIRES DE MARSEILLE ?
Les Hôpitaux ouvrent cette semaine la vaccination aux professionnels de santé libéraux en lien avec l’URPS ML et les Communautés professionnelles territoriales de santé (CPTS) : à Sainte-Marguerite dès ce soir 17h, à l’IHU méditerranée Infection au Centre de vaccination Internationale des cet am, demain à l’Hôpital de la Conception et mercredi et jeudi à la Timone et l’Hôpital Nord au sein des maisons médicales de garde.
Par ailleurs les retraités de l’AP-HM sont également invités à se faire vacciner dans les différents services de médecine du travail.
Coronavirus COVID-19 : Que connaissons-nous des vaccins de la COVID-19 à ce jour ? Quelle est leur balance bénéfice-risque ?
Information proposée par Société Française de pharmacologie et de thérapeutique
https://sfpt-fr.org/faq-vaccins
Cette FAQ, rédigée par la Société française de pharmacologie et de thérapeutique, présente de façon simple et didactique les différents aspects concernant les vaccins en général et en particulier les vaccins de la COVID-19. Elle est mise à jour de façon très régulière en fonction des nouvelles connaissances et des nouveaux résultats.
1 - COMMENT FONCTIONNE UN VACCIN ?
La réponse à cette question a fait l'objet d'un consensus d'experts.
Le but de la vaccination est « d’imiter » une infection par le virus, en administrant une forme atténuée ou inactivée d’un agent infectieux (ou certains de ses composants) afin de provoquer une réaction du système immunitaire qui produira alors les anticorps nécessaires pour prévenir ou réduire les risques d’infection, de dissémination du pathogène ou encore réduire la dangerosité d’une infection.
Cette défense face à une infection ultérieure est maintenue par la persistance de cellules immunitaires mémoires (Lymphocytes B, Lymphocytes T CD4/CD8) produit au décours de la vaccination.
Suite à une nouvelle rencontre avec l’agent infectieux, des cellules, qu’on appelle cellules présentatrices de l’antigène vont capter cet agent infectieux afin de le présenter, via des antigènes (protéines présentes sur la face externe donc visible par le système immunitaire ou des toxines du pathogène), aux cellules immunitaires mémoires permettant une réponse rapide (3 à 5 jours) médier par des lymphocytes T CD8 dit tueurs, et des lymphocytes B producteurs d’anticorps en autre.
Dans le cadre du SARS CoV-2 la protéine la plus « visée » par les candidats vaccins est la protéine S (Spicule), protéine responsable de l’infection des cellules par le virus.
Références
https://www.inserm.fr/information-en-sante/dossiers-information/vaccins-et-vaccinations Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
2 - COMMENT DÉVELOPPE-T-ON LES VACCINS EN GÉNÉRAL ?
La réponse à cette question a fait l'objet d'un consensus d'experts.
Les vaccins sont des médicaments. Leur développement traditionnel est un processus long, nécessitant une moyenne de 15 ans avant la mise sur le marché.
Les étapes pré-cliniques :
La conception du vaccin et son évaluation initiale sont réalisées sur des modèles cellulaires et animaux. Ceci est suivi par des étapes plus formalisées d’exploration de l’efficacité et de la toxicologie sur des modèles animaux en parallèle de travaux sur le processus de fabrication.
Les étapes cliniques : Phase 1 : réalisation des premiers tests de sécurité chez l’homme, sur des petits effectifs. Phase 2 : réalisation d’études sur la recherche de la dose efficace. Phase 3 : évaluation de son efficacité et description de sa sécurité sur une population volontaire avec un effectif plus large.
Pendant ces différentes phases, on étudie l’immunogénicité du vaccin candidat. Une fois ces résultats obtenus, le dossier du vaccin est soumis à une autorité de santé compétente, la Food and Drug Administration aux Etats-Unis, l’European Medicines Agency en Europe avant mise sur le marché.
On voit donc que ce processus est long, complexe, et il fait l’objet d’une évaluation économique à chaque étape.
Références
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
3 - COMMENT EXPLIQUER QUE L'ON METTE SI PEU DE TEMPS POUR DÉVELOPPER LES VACCINS DE LA COVID-19 ? SONT-ILS DES VACCINS TROP VITE CONÇUS ?
La réponse à cette question a fait l'objet d'un consensus d'experts.
La pandémie à Sars-Cov-2 a nécessité une réponse beaucoup plus rapide que le schéma traditionnel. Cette accélération a été facilitée par plusieurs facteurs :
Le plus important est le développement préalable de vaccins de deux « cousins » très proches du Sars-Cov-2, le Sars-Cov et le Mers-Cov. Ceci a permis d’utiliser toutes leurs données de conception et de production du vaccin pour les adapter au Sars-Cov-2. Ceci explique pourquoi la première étude clinique a eu lieu dès mars 2020. Le deuxième facteur est que le développement clinique a été réalisé de façon adaptative et beaucoup plus rapide, avec des essais de phase I/II progressant en phase III après analyses intermédiaires.
Référence :
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
- Le troisième facteur très important est qu’un risque financier a été pris par les entreprises pour avancer plus vite sans une assurance de rentabilité à chaque étape. Un exemple assez frappant est que plusieurs entreprises produisent déjà la forme commerciale avant la fin de leurs études de phase III, ce qui permet un énorme gain de temps, mais aussi un énorme risque financier si les études ne sont pas concluantes.
- Enfin, le quatrième facteur est que les autorités de santé évaluent les dossiers des candidats vaccins en urgence et de façon continue, avant même que le dossier final soit abouti.
- Ces 4 facteurs ont permis d’accélérer l’intégralité du processus de développement et de production en conservant toutes les évaluations habituelles de leur sécurité.
4 - COMBIEN DE VACCINS DE LA COVID-19 SONT EN DÉVELOPPEMENT AUJOURD'HUI ?
Le 8 décembre 2020, il y avait 214 vaccins candidats en cours de développement dont 52 sont en phase d’évaluation chez l’homme, parmi lesquels 13 sont en phase III, c’est-à-dire au stade de l’évaluation de leur efficacité chez l’homme avant leur mise sur le marché.
Référence
World Health organisation https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
5 - QUEL EST LE PANORAMA DES VACCINS DE LA COVID-19 ? POURQUOI Y A-T-IL AUTANT DE VACCINS EN COURS DE DÉVELOPPEMENT ?
Le développement des vaccins de la Covid-19 a utilisé toutes les technologies connues, parmi lesquelles on peut différencier 2 approches (figure) : l’utilisation de tout ou partie du virus, ou l’utilisation de son code génétique. Ceci explique qu’une grande variété de vaccins technologiquement très différents sont développés :
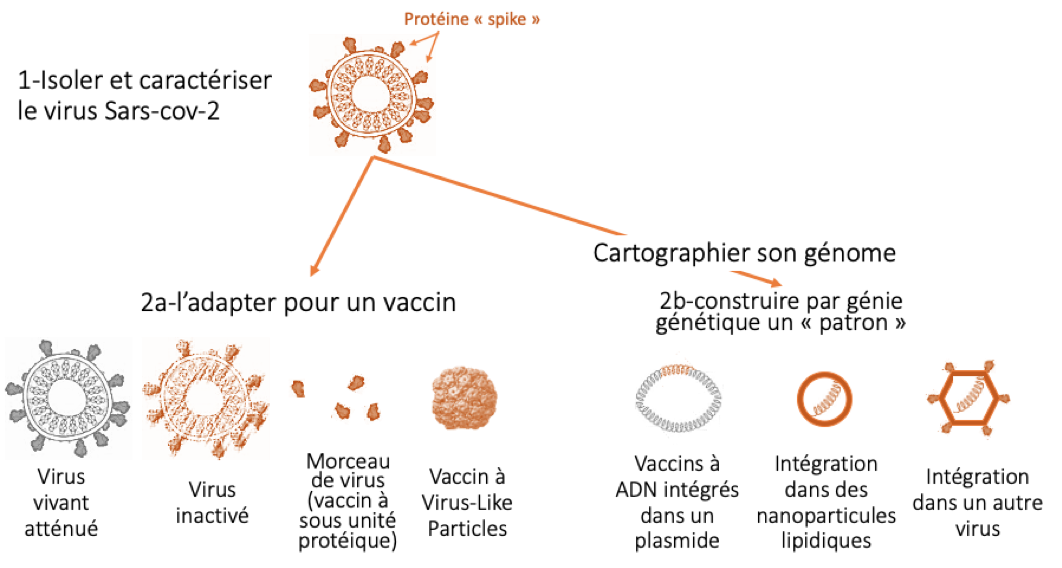
Les vaccins inactivés.
Ceci consiste à cultiver le virus Sars-Cov-2 sur des cellules puis de l’inactiver (c’est une technique traditionnelle que l’on retrouve pour le vaccin de la poliomyélite ou de la grippe) avant de l’injecter. Ces vaccins sont administrés par voie intramusculaire et peuvent nécessiter un adjuvant pour stimuler la réponse immunitaire.
Les vaccins vivants atténués.
Ceci consiste à injecter un virus Sars-Cov-2 dont la virulence est atténuée. L’avantage est que ces vaccins peuvent être administrés par voie nasale et procurer une protection des voies aériennes supérieures et donc protéger de l’infestation, et d’induire une forte réponse immunitaire sans adjuvant (historiquement, c’est par exemple le vaccin contre la rougeole). Par contre, l’énorme inconvénient est qu’il faut contrôler la virulence du vaccin, au risque de transmettre une maladie. Ces vaccins sont donc contre indiqués chez les patients immunodéprimés Il n’y a aujourd’hui que 3 vaccins de ce type en cours de développement.
Les vaccins à sous-unité protéique (environ 33% des candidats vaccins)
Appelés également vaccins à protéines recombinantes (c’est par exemple le virus contre l’hépatite B). Il s’agit d’injecter une partie du virus impliquée dans l’adhésion aux cellules humaines. Ces vaccins se différencient en 3 sous catégories :
- Les vaccins comportant la protéine « spike » qui permet l’ancrage du virus. Il s’agit de la majorité des vaccins développés.
- Les vaccins comportant uniquement la portion de la protéine « spike » qui se lie à son récepteur chez l’homme
- Les vaccins comportant des protéines « spike » assemblées pour former un faux virus, c’est ce qu’on appelle les vaccins à « virus-like-particles ». Ces vaccins permettent d’exposer de plus grandes quantités d’antigène au système immunitaire et sont plus immunogènes, permettant parfois de ne pas ajouter d’adjuvant.
L’avantage de ces vaccins est que leur processus de fabrication est connu et ne nécessite pas de virus vivant. Les inconvénients sont que cette technologie ne permet pas facilement de produire de grandes quantités de vaccins, et que leur immunogénicité modeste requiert la présence d’adjuvant pour stimuler le système immunitaire.
Les vaccins à vecteurs viraux non répliquant (environ 25% des candidats vaccins).
Ces vaccins consistent en l’utilisation d’un autre virus modifié pour exprimer la protéine « spike » pouvant infecter les cellules mais pas se multiplier. Ils sont principalement à base d’adénovirus, un virus connu, stable. L’avantage est que l’on ne manipule pas de virus Sars-Cov-2, que le processus de fabrication est connu (c’est le principe du vaccin contre le virus de l’Ebola). L’inconvénient potentiel est que l’on peut avoir une immunité préalable contre le virus vecteur, ou la créer avant la seconde injection du vaccin. La version à vecteurs répliquant est moins avancée en recherche clinique et permet théoriquement une meilleure immunité. Il existe aussi quelques vaccins à vecteurs viraux inactivés (n’entrant pas dans les cellules et ne se multipliant pas).
Les vaccins à acide nucléique :
Il s’agit d’une nouvelle famille de vaccins. Aucun vaccin n’est commercialisé avec cette technique, mais leur développement est antérieur à la pandémie covid-19 :
-
Les vaccins à ADN. Ils utilisent une partie du code génétique du Sars-Cov-2, intégré dans un morceau d’ADN bactérien circulaire (plasmide). Ils ont l’avantage de pouvoir être produits en grande quantité, mais posent le problème d’être souvent faiblement immunogènes. Il existe un risque théorique d’insertion dans le matériel génétique humain, qui n'est cependant pas retrouvé à ce jour. Quelques vaccins de ce type sont en développement.
- Les vaccins à ARN (environ 20 % des candidats vaccins). son traités dans la réponse 6
6 - QU'EST-CE QUE VACCIN ARN ?
Les vaccins à ARN (environ 20 % des candidats vaccins) font partie de la famille des vaccins à acide nucléique (voir la réponse 05)
Dans ces vaccins, l’information génétique de la protéine « spike » est contenue dans l’ARN. L’ARN étant une molécule instable, il est stabilisé dans des nanoparticules lipidiques* qui permettent également sa pénétration cellulaire et limitent sa dégradation dans la cellule. Cette technologie est récente, mais sert déjà à la conception d’autres vaccins comme celui du virus Zika ou du cytomégalovirus. Le principe est que l’ARN pénètre les cellules humaines et c’est la machinerie cellulaire qui produit la protéine « spike » d’intérêt. L’ARN ne pénètre pas dans le noyau de la cellule, et n’a donc pas la possibilité de s’insérer dans le génome. L’avantage est que l’on ne manipule à aucun moment de virus, et que les données disponibles à ce jour sont rassurantes en termes d’effets indésirables. L’inconvénient est que cela nécessite une gestion des stocks complexes (stockage dans des congélateurs), et que l’on a moins de recul qu’avec les autres types de vaccins.
* Une nanoparticule est une structure dont la taille est inférieure à 100 µm. Il existe 3 types de nanoparticules, les inorganiques (métalliques), polymères ou lipidiques. Les vaccins à ARN sont vectorisés par des nanoparticules lipidiques, c.à.d. composées de différents lipides. On utilise principalement des transporteurs lipidiques nanostructurés, mélange de lipides solides et liquides stabilisant le noyau lipidique.
7 - PAR QUELLE VOIE VONT ÊTRE ADMINISTRÉS LES VACCINS DE LA COVID ?
Tous les vaccins prochainement mis sur le marché seront administrés par voie intramusculaire. Les rares vaccins développés pour être administrés par voie intranasale ou sublinguale, qui présentent l’avantage de créer une immunité des voies aériennes, sont peu avancés en développement.
8 - LE VACCIN DE LA COVID VA-T-IL ME PROTÉGER À 100% ?
La réponse à cette question est issue d’un consensus d'experts.
Non, les vaccins injectés par voie intramusculaire n'éviteront que partiellement l’infection. Ils limiteront la réplication du virus et la progression vers des formes sévères de la Covid-19. C’est déjà le cas avec le vaccin de la grippe saisonnière qui diminue seulement de 50% l’infection mais protège des formes graves. Pour la Covid-19, la diminution des formes graves et de la réplication virale va diminuer la contagiosité.
L’efficacité d’un vaccin peut-être évaluée par les études cliniques qui comparent le risque relatif de développer la maladie entre une population vaccinée et une population non vaccinée et les études sérologiques reflétant la protection clinique de manière indirecte par la séroconversion après vaccination (deux à six semaines plus tard). A l’heure actuelle il n’existe pas de vaccin connu dont l’efficacité induit une protection à 100%.
Les dernières données publiées pour les 3 principaux vaccins en essais cliniques avancés rapportent une efficacité de 95% (Pfizer-BioNtech), 94% (Moderna) et 60 à 90 % (AstraZeneca) contre une infection à la covid-19. Cependant la durée d’efficacité de ces vaccins dans le temps n’est pas encore connue. Il ne s’agit que de résultats préliminaires et c’est pour cette raison que des essais cliniques se poursuivent.
Références :
Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW and Wen SCH (2020) Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front. Immunol. 11:579250. https://doi.org/10.3389/fimmu.2020.579250
P. Polack et al., Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. New England Journal of medicine; December 10, 2020 https://doi.org/10.1056/NEJMoa2034577
M Voysey et al., Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. https://doi.org/10.1016/ S0140-6736(20)32661-1. The Lancet. December 8, 2020. https://doi.org/10.1016/s0140-6736(20)32466-1
9 - LES SUJETS ÂGÉS SERONT-ILS PROTÉGÉS DE LA MÊME FAÇON PAR LE VACCIN ?
La réponse à cette question est issue d’un consensus d'experts.
On sait pour les personnes âgées que la réponse vaccinale est moins efficace du fait d’un système immunitaire moins actif (immunosénescence), c’est le cas pour le vaccin contre la grippe qui devient moins immunogène. L’efficacité de la réponse vaccinale est également moins longue dans le temps et c’est pourquoi des rappels sont nécessaires de manières plus précoces chez les personnes âgées, c’est le cas pour le vaccin Diphtérie-Tétanos-Poliomyélite.
La même question se pose pour les vaccins de la Covid-19, raison pour laquelle les essais cliniques de phase 3 incluent des sujets âgés ou à risque. L’objectif sera surtout de savoir si un type de vaccin doit préférentiellement être administré dans ces populations.
Références :
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3 .
- Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW and Wen SCH (2020) Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front. Immunol. 11:579250. https://doi.org/10.3389/fimmu.2020.579250
- Vaccination et personnes âgées : rapport du Haut Conseil de la Santé Publique - 2016
10 - LES VACCINS POURRAIENT-ILS AGGRAVER LA COVID-19 ?
La réponse à cette question est issue d’un consensus d'experts.
A priori, non. Des vaccins contre un autre virus, le virus respiratoire syncytial, non commercialisés, peuvent aggraver les infections ultérieures lorsque le vacciné développe des anticorps non neutralisants. Pour la Covid-19, les données des premiers essais cliniques ne montrent pas de cas de maladie respiratoire aggravée, en particulier d’aggravation médiée par les anticorps. Ce risque est cependant particulièrement suivi par les autorités de santé avec les vaccins en cours de développement.
Référence :
- Krammer, F. SARS-CoV-2 vaccines in development. Nature 586, 516–527 (2020). https://doi.org/10.1038/s41586-020-2798-3
11 - A QUELS EFFETS INDÉSIRABLES DOIS-JE M'ATTENDRE ? SONT-ILS LES MÊMES POUR TOUS LES VACCINS ?
La réponse à cette question est issue d’un consensus d’experts.
Comme pour toute prise de médicament, la vaccination peut entraîner la survenue d'effets indésirables. Quel que soit le vaccin, l’effet indésirable le plus fréquemment rencontré est la douleur au point d’injection, liée à l’administration intramusculaire du vaccin. On retrouve également fréquemment ce qu’on appelle un syndrome pseudo-grippal : fièvre, fatigue, maux de tête, douleurs musculaires. Ce syndrome peut durer quelques jours.
Concernant les vaccins en cours d’évaluation dans la Covid-19, les données sont rassurantes : aucun des vaccins actuellement en phase III du développement n’a montré d’effets indésirables graves. Leur profil de tolérance est similaire à ceux des vaccins en général, décrit ci-dessus.
Entre les différents types de vaccins contre la Covid-19, il semblerait que les vaccins vivants atténués soient les mieux tolérés, mais sont également les moins immunogènes. Les vaccins à adénovirus et à ARN entraînent quant à eux plus souvent une douleur au point d’injection et de la fièvre. C’est pour cette raison que leur administration peut s’accompagner d’une prise de paracétamol par voie orale.
Références :
- Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW, Wen SC. Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front Immunol. 2020 Oct 2;11:579250. https://doi.org/10.3389/fimmu.2020.579250
12 - COMMENT VA-T-ON VÉRIFIER QUE LES VACCINS DE LA COVID-19 SONT SÛRS ?
La réponse à cette question est issue d’un consensus d’experts.
Avant la mise sur le marché (AMM)
Il semble important de rappeler que comme pour tout médicament, la sécurité d’emploi d’un vaccin fait partie intégrante de chacune des étapes de son développement, au même titre que l’évaluation de son efficacité. D’ailleurs, cette considération implique généralement d’inclure suffisamment de personnes dans les essais cliniques, et de les suivre sur une durée suffisante pour s’assurer d’objectiver un profil de tolérance représentatif, et de pouvoir mettre en évidence les effets indésirables moins fréquents et inattendus.
Ce n’est qu’à la condition d’une balance “bénéfices-risques” favorable, établie sur les critères d’efficacité et de sécurité, qu’un vaccin, ou tout autre médicament, peut obtenir son autorisation de mise sur le marché (AMM).
Toutefois, compte tenu du relativement faible nombre de personnes incluses dans les essais cliniques et de la durée courte du suivi, seuls les effets les plus fréquents et de survenue précoce sont susceptibles d’être détectés (par exemple, si l’étude a inclus 10 000 personnes, un effet qui surviendrait chez 1 patient sur 100 000 n’a que très peu de chance de survenir).
Une fois l’AMM obtenue
Une fois sur le marché, la surveillance du médicament, du vaccin, ne s’arrête pas : c’est ce qu’on appelle la phase IV du développement, où intervient la pharmacovigilance. En effet, dans des conditions d’utilisation “en vie réelle”, sur une plus large population que dans le cadre des essais cliniques, des effets rares, complexes (liés au terrain du patient ou à des interactions médicamenteuses par exemple), ou tardifs peuvent être mis en évidence.
Tout l’enjeu de la pharmacovigilance est donc de garantir que la balance “bénéfices-risques” du médicament, du vaccin, reste positive dans ses conditions d’utilisation dans la population, et ce durant toute la vie du vaccin. En cas de mise en évidence d'un nouveau risque, des mesures de minimisation des risques peuvent être mises en place. Par exemple, si on se rend compte qu’une population définie est plus à risque de faire un effet indésirable particulier avec un vaccin précis, on pourra contre-indiquer ce vaccin à cette population, et on lui recommandera plutôt un autre vaccin qui n’est pas à risque de provoquer cet effet indésirable.
Pour en savoir plus sur la pharmacovigilance : reportez-vous à la question #153.
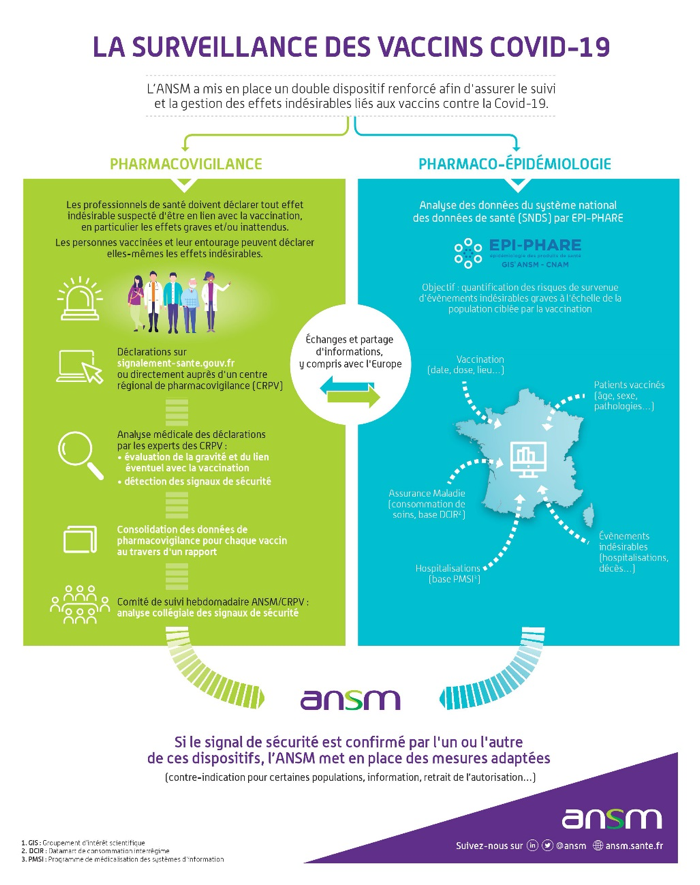
Ainsi, en France, la sécurité des vaccins de la Covid-19 commercialisés fait l’objet: d’une part, d’un suivi en pharmacovigilance, via les Centres Régionaux de Pharmacovigilance (CRPV), et d’autre part du suivi systématique d’une cohorte de patients. Tous deux sont sous la responsabilité de l’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM).
Le suivi de pharmacovigilance en France s’intègre dans le plan de gestion des risques coordonné par l’Agence Européenne du Médicament (EMA). De plus, la sécurité sera surveillée au niveau mondial par l’Organisation Mondiale de la Santé (OMS) qui centralise le suivi à Uppsala, en Suède.
En pratique, pour les vaccins de la COVID-19
Pour permettre aux CRPV de détecter des signaux, il faut que les effets indésirables soient déclarés. Cette déclaration peut être faite par les professionnels de santé ou par les patients eux-mêmes.
Attention : l’objectif n’est pas de faire une revue exhaustive des effets indésirables bénins déjà connus et étudiés dans le cadre des essais cliniques, mais de mettre en évidences des effets indésirables graves et/ou nouveaux, ayant conduit à une consultation médicale ou à une hospitalisation.
Ainsi, il n’est pas pertinent voire même contre-productif de déclarer la survenue d’effets connus et bénins, comme la survenue d’une fièvre modérée, ou de maux de têtes par exemple. Ceci risquerait d’engorger le système et de retarder la détection d'effets indésirables graves ou nouveaux.
Le 24/12/2020, l'ANSM a publié un point d'information sur le dispositif de surveillance renforcée des vaccins.
Il comprend en particulier des guides de déclaration pour les patients et pour les professionnels de santé, ainsi qu'une fiche récapitulant les effets indésirables pouvant survenir après la vaccination
Afin d’aider les CRPV dans leur mission, des moyens humains supplémentaires ont été demandés. Mais ce n’est pas la seule aide dont ils vont disposer.
A partir de la mi-janvier, un système d’intelligence artificielle va être déployé. L’objectif ne sera pas de remplacer l’expertise humaine mais de fluidifier la chaine d’analyse. En effet, l’intelligence artificielle interviendra entre la déclaration des patients via le portail de signalement des événements sanitaires indésirables https://signalement.social-sante.gouv.fr/
et l’expertise des pharmacovigilants des CRPV (les déclarations provenant des médecins seront analysées en priorité sans passer par ce système).
L’intelligence artificielle va dans un premier temps transformer les verbatims contenus dans les déclarations des patients en termes médicaux selon la classification MedDRA utilisée dans les CRPV. Ensuite, elle analysera ces termes pour trier les déclarations « graves » et « non graves », sans juger du rôle qu’a joué le vaccin dans la survenue de l’effet. Ceci va permettre aux pharmacovigilants des CRPV de prioriser leurs analyses, et ainsi d’être plus réactifs dans la mise en évidence de signaux.
Les déclarations non urgentes seront traitées dans un deuxième temps.
Pour information, l’intelligence artificielle stockera uniquement les données anonymisées, et le logiciel est régit par le cahier des charges de l’ANSM en termes de sécurités des données.
Pour des informations détaillées sur la procédure de suivi, voir la QR13
Références :
- Flanagan KL, Best E, Crawford NW, Giles M, Koirala A, Macartney K, Russell F, Teh BW, Wen SC. Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines. Front Immunol. 2020 Oct 2;11:579250. doi: 10.3389/fimmu.2020.579250. PMID: 33123165; PMCID: PMC7566192.
- https://www.ansm.sante.fr/Dossiers/COVID-19-Vaccins/COVID-19-Les-vaccins/
- https://www.ansm.sante.fr/S-informer/Points-d-information-Points-d-information/Campagne-de-vaccination-contre-la-Covid-19-L-ANSM-deploie-son-dispositif-de-surveillance-renforcee-Point-d-Information
13 - EN PRATIQUE, COMMENT VA SE DÉROULER LE SUIVI DES EFFETS INDÉSIRABLES DES VACCINS COVID ?
La réponse à cette question est issue d’un consensus d’experts.
L’objectif est de détecter des effets nouveaux et/ou graves qui peuvent être des signaux de sécurité, non identifiés dans les essais cliniques. Cette détection doit se faire en temps réel et s’appuie sur le principe de la notification spontanée des effets indésirables par les acteurs du système de soins, professionnels de santé et patients.
Les déclarations d’effets indésirables liés aux vaccins contre la COVID-19 gérées par les CRPV puis enregistrées dans la base française de pharmacovigilance et les déclarations enregistrées par les firmes commercialisant les vaccins seront analysées dans le cadre d’une enquête de pharmacovigilance mise en place par l’ANSM et confiée à des CRPV experts, nommés par l’ANSM. Ils sont au nombre de 2 par vaccin. Pour le vaccin Comirnaty® (BNT162b2), il s'agit des centres de Bordeaux et Marseille
Ce travail de synthèse permettra d’avoir une analyse globale afin de détecter de nouveaux signaux potentiels de sécurité : nouveaux effets, gravité inattendue, facteurs de risques potentiels…
Ces analyses feront l’objet d’un rapport hebdomadaire par les CRPV experts qui sera discuté au sein d’un comité de suivi constitué par l’ANSM. Ce comité réunit des membres de l’ANSM et des représentants des CRPV. D’autres données seront également discutées afin de croiser les signaux : essais cliniques, veille documentaire scientifique et veille statistique de la base nationale de pharmacovigilance.
Il est également prévu des études de pharmacoépidémiologie basées sur les données du Système National des Données de Santé (SNDS). Ces études permettront également, si nécessaire, d’explorer des signaux identifiés par la pharmacovigilance.
L’ensemble de éléments analysés permettra de prendre des mesures de minimisation du risque adaptées, d’alerter, le cas échéant, l’EMA, les professionnels de santé et les patients et permettra également au Ministère chargé de la Santé d’adapter la stratégie de vaccination, si nécessaire.
Par ailleurs, en cas d’un signal détecté en France, ou à l’international, susceptible de conduire à une réévaluation du rapport bénéfice-risques des vaccins, les autorités compétentes des Etats membres de la communauté européenne s’informeront mutuellement afin de prendre des dispositions concertées.
Enfin, au cours de la première phase de vaccination, au niveau de chaque région, les CRPV seront en contact direct avec les établissements hébergeant des personnes âgées afin de recueillir les effets indésirables potentiels des vaccins.
Chaque semaine, l’ANSM publiera sur son site Internet les données de pharmacovigilance et les faits marquants, comme cela est fait pour l’enquête sur les médicaments utilisés dans la COVID-19 depuis mars 2020.
Pour en savoir plus, consultez le site du réseau français des CRPV
14 - QUAND POURRAIS-JE ÊTRE VACCINÉ(E) ?
La réponse à cette question est issue de recommandations préliminaires publiées par l’HAS le 30 novembre 2020 et précisées le 18 décembre 2020.
Elles décrivent 5 phases suivant l’approvisionnement progressif en vaccins et des ordres de priorité prenant en compte 2 critères principaux :
- l’existence d’un facteur de risque individuel de développer une forme grave de la maladie (personne âgée, obésité, BPCO et insuffisance respiratoire, hypertension artérielle compliquée, insuffisance cardiaque, diabète de type 1 et 2, insuffisance rénale chronique, cancers récents de moins de trois ans, transplantation d’organe solide et de cellules souches hématopoïétiques et trisomie 21) et
- l’exposition accrue au virus.
Elles précisent également les personnes non inclues dans les populations à vacciner en priorité : les femmes enceintes et les personnes ayant déjà eu la Covid-19 sous forme symptomatique (pas de vaccination systématique mais possibilité après décision partagée avec le médecin en respectant un délai minimal de 3 mois à partir du début des symptômes). Par ailleurs, à ce jour, la HAS recommande de ne pas tenir compte d’une éventuelle préalable sérologie positive ou négative pour décider de la vaccination.
1ère phase :
- Personne âgées résidant en établissement d’hébergement pour personnes âgées dépendantes (EHPAD) ou tout autre hébergement collectif.
- Professionnels du secteur de la santé, du secteur médico-social et du transport sanitaire en priorisant les professionnels travaillant en EHPAD et USLD et qui présentent eux-mêmes un risque de forme grave (âge > 65 ans et/ou comorbidités).
Cette phase a débuté en France le 27 décembre, en utilisant le vaccin BNT162b2 de BioNTech - Pfizer
2ème phase :
- Personnes de plus de 75 ans
- Personnes de 65 à 74 ans ayant une comorbidité
- Puis les personnes de 65-74 ans sans comorbidités
- Poursuite de la vaccination des professionnels du secteur de la santé, du secteur médico-social et du transport sanitaire quel que soit leur lieu d’exercice, et âgés de plus de 50 ans ou présentant une comorbidité.
3ème phase :
- Personnes de plus de 50 ans
- Personnes de moins de 50 ans mais à risque de forme grave du fait de leurs comorbidités.
- Personnes de moins de 50 ans et sans comorbidités issus des secteurs indispensables au fonctionnement du pays (sécurité, éducation)
4ème phase :
- Personnes de moins de 50 ans et sans comorbidités dont l’environnement favorise une infection (contacts réguliers du public, milieu clos...) ou vulnérables ou précaires (résidant en hôpital psychiatrique, sans domicile fixe, détenus…).
5ème phase :
- Généralisation de la vaccination à l’ensemble de la population de plus de 18 ans et sans comorbidités
Références :
- https://www.has-sante.fr/jcms/p_3221237/fr/vaccins-covid-19-quelle-strategie-de-priorisation-a-l-initiation-de-la-campagne
- https://www.has-sante.fr/jcms/p_3225633/fr/vaccination-contre-la-covid-19-la-has-precise-ses-recommandations-sur-la-priorisation-des-publics-cibles
15 - POURQUOI FAUT-IL VACCINER UNE LARGE PROPORTION DE LA POPULATION ?
La réponse à cette question est issue d’un consensus d’experts.
L’immunité collective
L’objectif de la vaccination est, bien entendu, de protéger l’individu vacciné, mais également de protéger l’ensemble de la population dans laquelle circule le virus. On appelle cela, l’immunité collective.
L’immunité collective est définie comme le seuil de protection de la population à partir duquel un individu infecté dans cette population pourrait contaminer moins d’une personne, ce qui, à terme, permettrait d’éliminer le virus de cette population. La protection de la population peut être obtenue par immunité naturelle (les patients infectés ont survécu et ont développé des anticorps contre l’agent infectieux), ou par la vaccination (les personnes ont développé des anticorps grâce au vaccin). Ensuite, le seuil à atteindre pour bénéficier de cette immunité collective dépend de la maladie et, d’en autre, de sa contagiosité. A titre d’exemple, il faut au moins 95% de la population vaccinée contre la Rougeole pour nous en protéger collectivement.
Compte-tenu des conséquences sanitaires de la pandémie de la Covid-19, il est éthiquement inconcevable de ne compter que sur l’immunité naturelle pour obtenir une immunité collective. De plus, dans la plupart des pays du monde, on estime que moins de 10% de la population a été infectée par le virus de la COVID-19.
Ainsi, il est plus que nécessaire de vacciner le plus largement possible, afin d’atteindre rapidement ce seuil de protection collective. A ce jour, ce seuil pour la Covid-19, n’est pas encore établi avec certitude, car il dépend de multiples facteurs, mais d’après l’Institut Pasteur, il devrait se situer autour des 70%.
La faisabilité
Une fois un vaccin efficace et sûr obtenu, il faut encore pouvoir être en capacité de vacciner le plus largement possible, et le plus justement possible.
Ainsi, depuis le mois de mai 2020, l’OMS a mis en place l’ACT ACCELERATOR, permettant d'accélérer les recherches et la mise à dispositions entre autres des vaccins et de façon équitable dans le monde.
A l’échelle nationale, la Haute Autorité de Santé a émis des recommandations quant à l’ordre dans lequel la population française pourra être vaccinée. La vaccination en France devra donc commencer par les résidents d’EHPAD et les professionnels de santé en première ligne face à la COVID-19. L’ordre prévisionnel de vaccination complet est disponible ici : https://www.has-sante.fr/jcms/p_3221237/fr/vaccins-covid-19-quelle-strategie-de-priorisation-a-l-initiation-de-la-campagne
Références :
- https://www.pasteur.fr/fr/espace-presse/documents-presse/qu-est-ce-que-immunite-collective
- https://www.who.int/fr/news-room/q-a-detail/herd-immunity-lockdowns-and-covid-19
- https://www.who.int/publications/m/item/access-to-covid-19-tools-(act)-accelerator
16 - JE SUIS SOUS UN TRAITEMENT POUR UNE PATHOLOGIE CHRONIQUE, PUIS-JE ME FAIRE VACCINER CONTRE LA COVID-19 ?
La réponse à cette question a fait l'objet d'un consensus d'experts.
Oui, à l’heure actuelle la vaccination contre la COVID-19 est recommandée chez des patients sous traitements chroniques. Il n’a pas été observé au cours des essais de phase III de différences d’efficacité ou de tolérance chez les patients ayant un/des traitement(s) chronique(s).
Les facteurs de risques individuels de développer une forme grave de la maladie (personne âgée, obésité, BPCO et insuffisance respiratoire, hypertension artérielle compliquée, insuffisance cardiaque, diabète de type 1 et 2, insuffisance rénale chronique, cancers récents de moins de trois ans, transplantation d’organe solide et de cellules souches hématopoïétiques et trisomie 21) sont un critère de priorisation de la vaccination.
Concernant les traitements immunosuppresseurs, les patients sous traitements immunosuppresseurs n’ont pas été inclus dans les essais de phase III des vaccins commercialisés à ce jour. Toutefois les vaccins à ARN présentent l’avantage d’absence de manipulation du virus contrairement aux vaccins vivants atténués qui sont eux contre-indiqués chez les patients immunodéprimés.




