Thrombocytopénie liée à l'ETV6 : l’analyse « single-cell RNA seq » révèle un blocage dans la formation des mégacaryocytes
Les thrombocytopénies (ou thrombopénies) sont définies par un nombre de plaquettes dans le sang inférieur à 150 G/L (150x109/L), entraînant des saignements ou associés à des manifestations hématologiques ou extrahématologiques.
D’origine génétique, les thrombopénies constitutionnelles (ou héréditaires) sont des maladies rares prises en charge par le Centre de Référence des Pathologies Plaquettaires (CRPP, Pr M.C. ALESSI), résultant le plus souvent d’un défaut de production des plaquettes1.
4% d’entre elles sont dues à des mutations germinales du gène du facteur de transcription ETV6, et sont associées à une prédisposition à la leucémie aiguë lymphoblastique (LAL) ou à la leucémie aiguë myéloblastique (LAM).
Des études avaient montré que ETV6 joue un rôle important dans la maturation des mégacaryocytes (MK)2 et la formation des plaquettes.
Mais à quel(s) niveau(x) le ETV6 muté/dysfonctionnel induit-il la thrombocytopénie ? Le CRPP de Marseille vient de publier le fondement de la réponse dans le Journal of Thrombosis and Haemostasis, de renommée internationale (facteur d’impact 2022 : 16.041).
1) Liens pour en savoir plus :
- MHEMO_Les pathologies plaquettaires
- Orphanet_Maladie hémorragique rare par thrombocytopénie constitutionnelle
2) Aussi appelé mégacaryopoïèse : différenciation ou la maturation des mégacaryocytes dans la moelle osseuse
3) AMIDEX « Emergence of Innovation » ngSUMMIT, ANR JCJC MOST, INSERM (PIA Biofit), ITMO Cancer of AVIESAN dans le cadre du Plan Cancer (Projet N°C190465)
4) Le CD34 est un marqueur des cellules souches / progénitrices hématopoïétiques
• Single-cell analysis of megakaryopoiesis in peripheral CD34+ cells: insights into ETV6-related thrombocytopenia
Par T Bigot, E Gabinaud, L Hannouche, V Sbarra, E Andersen, D Bastelica, C Falaise, D Bernot, M Ibrahim-Kosta, PE Morange, M Loosveld, P Saultier, D Payet-Bornet, MC Alessi, D Potier, M Poggi
J Thromb Haemost. 2023 PMID: 37085035 DOI: 10.1016/j.jtha.2023.04.007
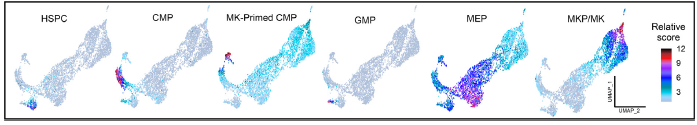
Figure tirée de la Figure 1 de l’article de Bigot T et al. J Thromb Haemost. 2023. Analyse des stades de la mégacaryopoïèse sur cellules CD34+ de témoins sains.
Graphes de type UMAP où chaque point représente une cellule CD34+ analysée issue des témoins sains. Chaque graphe représente l’évaluation d’un type cellulaire grâce à sa signature génomique spécifique. Le gradient de couleur est associé au score relatif de la signature.
HSCP : cellules souches/progénitrices hématopoïétiques ; CMP : progéniteurs myéloïdes communs ; GMP : progéniteurs myéloïdes exprimant des marqueurs spécifiques ; MEP : progéniteurs MK-érythroïdes, MPK/MK : progéniteurs MK et MK matures (MKP/MK)